马上注册,结交更多好友,享用更多功能,让你轻松玩转社区。
您需要 登录 才可以下载或查看,没有账号?立即注册

x
美国时间2017年7月12日,FDA肿瘤药物专家咨询委员会(ODAC)以10:0的投票结果一致支持批准诺华CAR-T疗法Tisagenlecleucel(CTL-019)上市。CTL-019申请的适应症是复发或难治性儿童和年轻成人急性淋巴细胞白血病(ALL)。FDA预计将于10月3日前依据专家意见做出最终审批决定。不出意外的话,CTL-019将成为全球首个获批上市的CAR-T疗法。
什么是CAR-T疗法
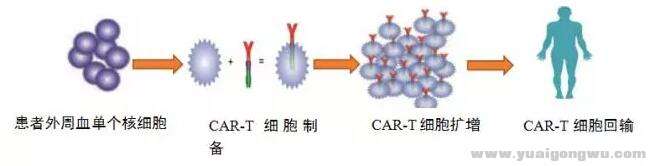
CAR-T,全称是chimeric antigen receptor T-cell immunotherapy,即嵌合抗原受体T细胞免疫疗法。和PD-1等免疫疗法类似,它的原理也是激活患者自身的免疫细胞来清除癌细胞。但与PD-1不同的是,CAR-T是一种细胞疗法,而不是一种药。
CRA-T治疗简单来说可分解为以下几个步骤:从癌症患者身体中分离出免疫T细胞——利用基因工程技术给T细胞加入一个能识别特定肿瘤细胞的元素,令T细胞具有杀死该种肿瘤细胞的嵌合抗体——在实验室中大量培养CAR-T细胞——将培养好的CAR-T细胞输回患者体内(听起来特别高大上,事实也的确如此)。
图一
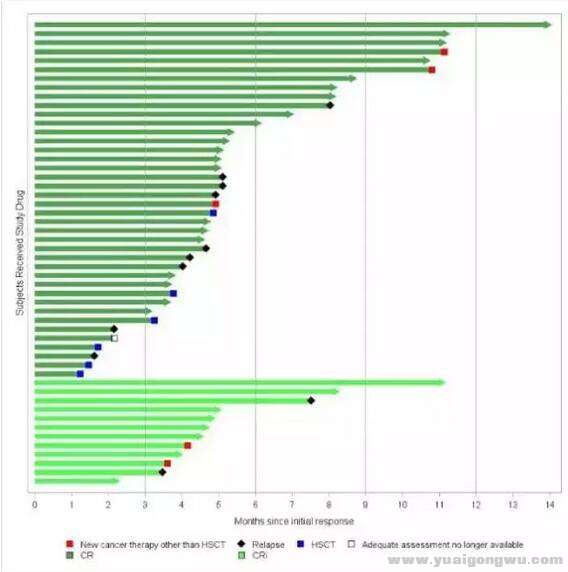
CTL-019疗法的临床表现
图二
资料显示,Study B2202研究入组的88例急性淋巴细胞白血病患者中,有63例是在美国完成的CAR-T制备和输注。在这63例患者中,52例实现应答,其中40例在输注后的前3个月内实现完全缓解(观察到肿瘤消失)。52例产生应答患者的中位随访时间4.8个月,中位应答持续期数据尚未获得。29例患者在诺华提交生物技术许可协议时仍维持缓解,这29例患者的随访时间均接近1年。
来源:FDA Statistical Reviewer
基于上述表现,FDA肿瘤药物专家咨询委员会全票支持CTL-019上市。当然,疗效持续时间、治疗的毒副作用也在专家咨询委员会考虑的范围之内。诺华此前表示,仍会继续对CAR-T产品的制备过程进行优化,以降低失败率,保证满足批量生产的需求。
另外,CAR-T是为数不多的中国不落后于西方国家的药品研发领域,中国在ClinicalTrials.gov登记的CAR-T相关临床研究数量仅次于美国,而且国内开展的细胞免疫治疗还处于试验阶段,多数都是免费的。有相关需求的患者可以自行查询了解。
总而言之,这将成为癌症治疗史上一次伟大的变革。相信随着肿瘤研究的不断深入,CAR-T疗法将成为人类对抗癌症的一大利器,也相信类似这样的利器将越来越多、越来越强大。或许在不久的将来,癌症将变为历史。
更多PD-1/PD-L1免疫治疗信息可关注新加坡泰和国际医院中国转诊办公室。 |
-
图二
-
图一
|
|
|
|
|
|
共3条精彩回复,最后回复于 2017-7-16 22:45

尚未签到
是真的,不过还是要提醒:
CAR-T技术越来越完善,但是肯定少不了浑水摸鱼的;
目前批准的是诺华的一种,并不代表所有CAR-T都是被批准的;
国外的价格可以用天价形容;
再次提醒注意区分。 |
|
|
|
|
|
|

尚未签到
泰和肿瘤大讲堂 发表于 2017-7-14 09:13
是真的,不过还是要提醒:
CAR-T技术越来越完善,但是肯定少不了浑水摸鱼的;
目前批准的是诺华的一种, ...
有国内临床试验入组信息吗?
|
|
|
|
|
|
|